Processos Patológicos Gerais
Processos Patológicos Gerais
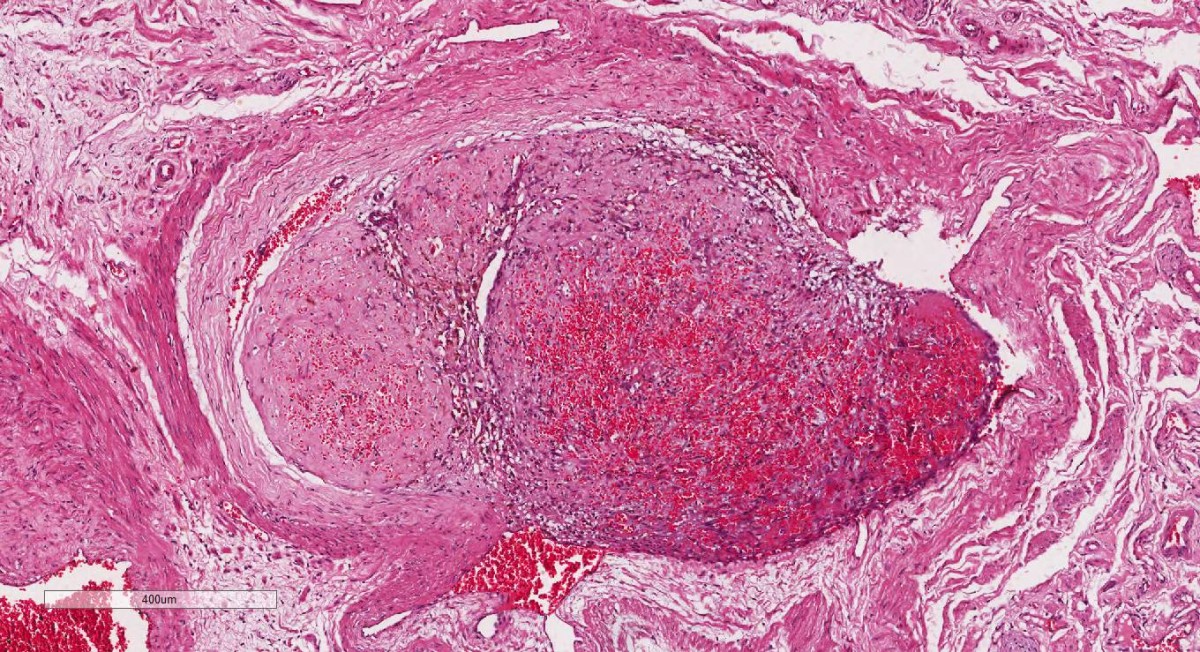
Neoplasias Benignas - permanecem restritos ao seu local de origem e, em geral, são passíveis de remoção cirúrgica. Elas podem causar vários transtornos (obstrução de órgãos ou estruturas ocas, compressão de órgãos, produção de substâncias em maior quantidade etc.), inclusive morte.
Nomenclatura: em geral, acrescenta-se o sufixo “-OMA” ao nome do tipo de célula que deu origem ao tumor.
Características gerais: células geralmente bem diferenciadas com discretas atipias celulares e arquiteturais e com baixo índice mitótico o que reflete o seu crescimento lento. Os tumores são bem delimitados.
Aspectos microscópicos: crescimento é do tipo expansivo e comprime as estruturas adjacentes, que sofrem hipotrofia; geralmente, cápsula fibrosa ao redor da massa tumoral.
Kumar, Vinay, et al. Robbins & Cotran Patologia: Bases Patológicas das Doenças. Disponível em: Grupo GEN, (10th edição). Grupo GEN, 2023.
BRASILEIRO FILHO, Geraldo. Bogliolo - Patologia. Disponível em: Grupo GEN, (10th edição). Grupo GEN, 2021.
Se a agressão que desencadeou o processo inflamatório for de baixa intensidade e houver a destruição total do agente flogógeno e do tecido necrótico dentro de poucos dias, a área inflamada será restaurada e dizemos que houve, então, a resolução completa da inflamação (isto é, destruição do agente flogógeno, neutralização dos mediadores químicos, normalização da permeabilidade dos vasos, remoção do líquido do edema e cessação da saída de neutrófilos dos vasos), caracterizando a inflamação aguda.
Porém, quando a resposta inflamatória aguda não pode resolver o problema da agressão em decorrência da persistência do agente nocivo ou da interferência no processo normal de cura, há a transição da inflamação aguda para a inflamação crônica. Neste momento, os sinais cardinais da inflamação estão bem atenuados, e há predominância de fenômenos proliferativos (síntese de tecido reparador) ao invés da fenômenos exsudativos (característicos da inflamação aguda).
As células predominantes na inflamação crônica são os macrófagos e os linfócitos. Os macrófagos são importantes células imunitárias que têm longa vida tecidual e grande capacidade fagocítica, além de serem importantes células apresentadoras de antígeno e produtoras de diversas citocinas. Já os linfócitos exibem variadas funções, como por exemplo, produzem muitas citocinas que ativam macrófagos (linfócitos T), produzem anticorpos (linfócitos B) e ainda funcionam como “matadoras naturais” (natural killers).
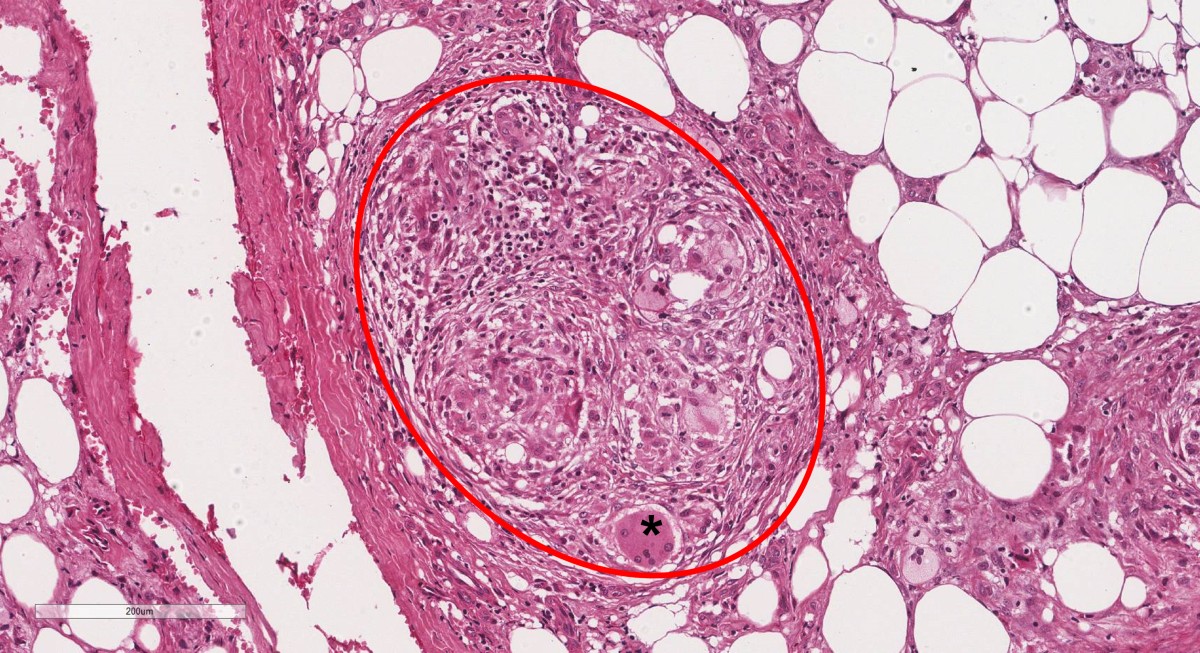
Ainda podemos distinguir 2 tipos de inflamação crônica: a granulomatosa e a não-granulomatosa. Na inflamação crônica não granulomatosa, observa-se a presença distribuída de forma dispersa de infiltrado inflamatório composto predominantemente por linfócitos e macrófagos. Já a inflamação crônica granulomatosa também é composta por macrófagos e linfócitos, mas organizados de forma compacta, com formação de tecido conjuntivo fibroso, muitas vezes formando cápsula, formando granulomas. Outros tipos celulares também podem estar presentes na inflamação crônica, tais como as células gigantes tipo corpo estranho e células gigantes tipo Langhans.
Inflamação aguda
Uma inflamação aguda acontece geralmente nas primeiras horas após uma agressão, e é caracterizada por aumento no fluxo sanguíneo local, vasodilatação e aumento da permeabilidade vascular, causada por mediadores químicos liberados no microambiente inflamatório. Devido a esses fenômenos vasculares, há a saída de células e líquido rico em proteínas para o meio extra vascular. Essas alterações teciduais levam a formação de sinais e sintomas mais pronunciados, conhecidos como os 5 sinais cardinais da inflamação, que são: tumor (edema), dor, rubor (vermelhidão) e calor (hipertermia). Com o agravamento do processo, pode haver perda de função do órgão, completando os sinais cardinais da inflamação.
As principais células a agirem nas primeiras horas de um processo inflamatório agudo são os neutrófilos. Esses leucócitos polimorfonucleares têm núcleos irregulares e citoplasma cheio de grânulos primários e secundários (granulócitos). Possuem, em sua superfície, receptores para opsoninas (IgG e C5), que facilitam o reconhecimento das partículas que precisam ser ingeridas e destruídas. Os neutrófilos são, portanto, fagócitos, capazes de emitir pseudópodes e englobar partículas, digerindo-as em seu citoplasma. Os neutrófilos estão especialmente envolvidos na destruição de bactérias e fungos.
Após o reconhecimento e ingestão da partícula fagocitada, forma-se intracitoplasmaticamente um fagossoma, e logo irá se juntar aos lisossomas e outros grânulos celulares, formando o fagolisossoma. Nessa estrutura formada, enzimas hidrolíticas e espécies reativas de oxigênio destruirão a partícula ingerida. São exemplos de enzimas presentes nos grânulos dos neutrófilos: colagenase, elastase, lactoferrina, fosfatase alcalina e defensina, dentre outras.
Embora numerosos na corrente sanguínea, os neutrófilos têm uma vida curta tanto dentro como fora dos vasos, se comparado a outras células, como os linfócitos e macrófagos. Depois da diapedese, isto é, fora dos vasos, a meia vida de um neutrófilo é de cerca de 48h, havendo necessidade de outras células participarem do processo de defesa do organismo se os neutrófilos não derem conta, estabelecendo-se uma inflamação crônica.
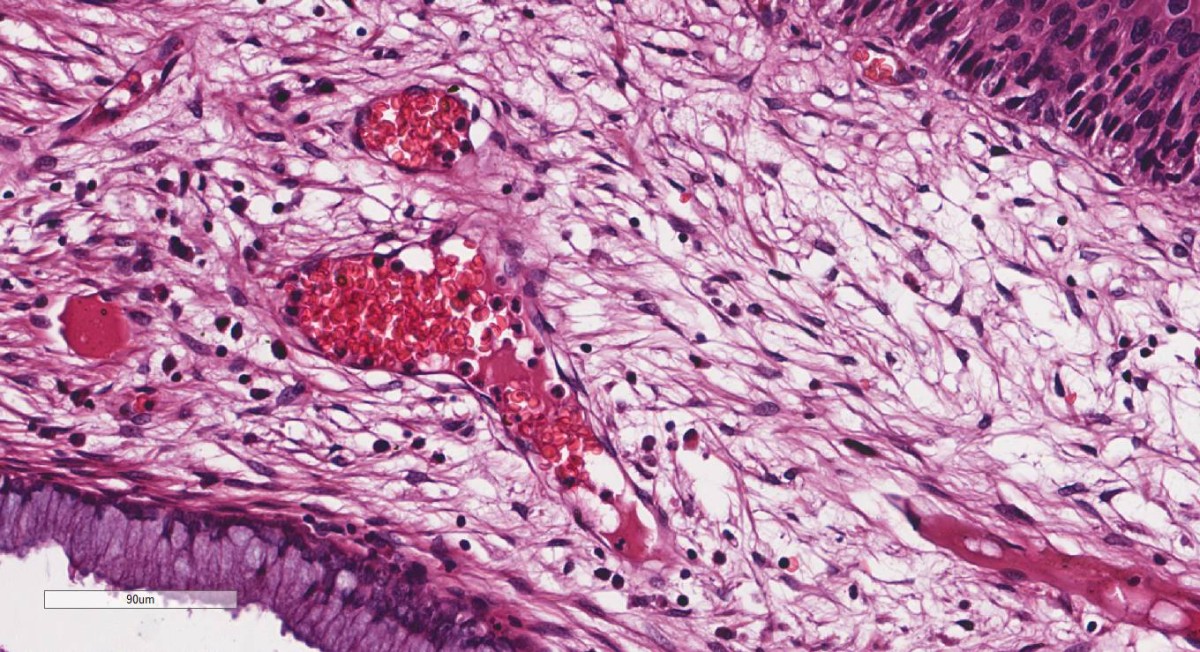
Lesão celular reversível: definida como a perturbação da função e morfologia das células que podem ser recuperadas se o estímulo nocivo for removido. A célula e as organelas intracelulares ficam inchadas porque absorvem água como resultado da falha das bombas iônicas dependentes de energia na membrana das células. O acúmulo de água no meio intracelular pode ser denominado de degeneração hidrópica ou vacuolar. Em alguns casos, pode haver degeneração de organelas e acúmulo intracelular de lipídeos (degeneração gordurosa).
Macroscopicamente, um órgão com muitas células afetadas pode apresentar-se pálido, túrgido (inchado, dilatado) e com peso aumentado.
Microscopicamente, as células apresentam vacúolos claros no citoplasma que representam a distensão e compressão do retículo endoplasmático.
KUMAR, V; ABBAS; A.K.; ASTER, J.C.; ROBBINS, A.T.K. Basic Pathology, Eleventh Edition. Philadelphia. Elsevier. 2022.
Choque
Conceito: É um estado de insuficiência circulatória e hemodinâmica, levando a uma diminuição da perfusão dos tecidos (Hipotensão sistêmica - por redução do débito cardíaco ou redução efetiva do volume sanguíneo circulante) com resultante utilização inadequada do oxigênio pela célula ou diminuição de oxigênio ofertado.
Classificação
- Cardiogênico: Falha na bomba cardíaca
- Hipovolêmico: Redução do volume sanguíneo ou plasmático
- Séptico: Acúmulo de sangue nos tecidos periféricos devido a: lesão/ativação de células endoteliais, lesão induzida por leucócitos, CID, ativação das cascatas de citocinas
- Neurogênico: Lesão medular com vasodilatação e acúmulo de sangue nos tecidos periféricos
- Anafilático: Vasodilatação periférica com acúmulo de sangue e um aumento da permeabilidade, nos estados de hipersensibilidade mediada por IgE.
Estágios Clínicos do choque e Fisiopatologia dos eventos Clínicos
- Estágio não progressivo ou compensado
Ação dos mecanismos compensadores: estimulação simpática, barorreceptores, catecolaminas, ativação da renina e secreção de ADH
- Estágio progressivo ou descompensado
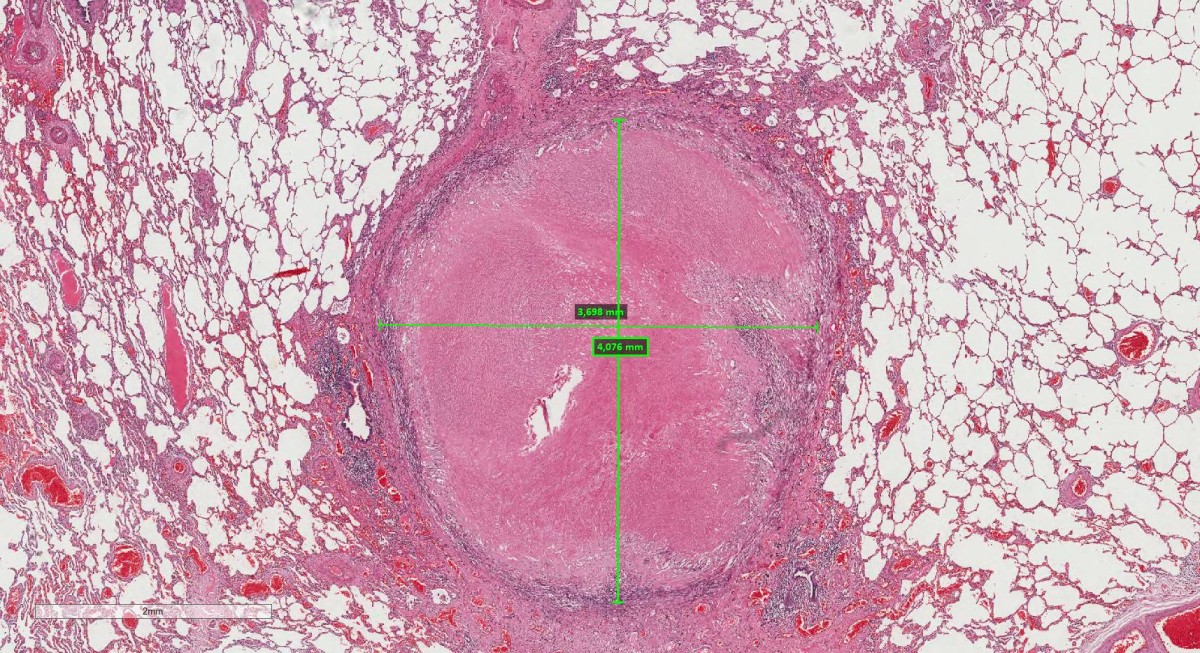
Conceito
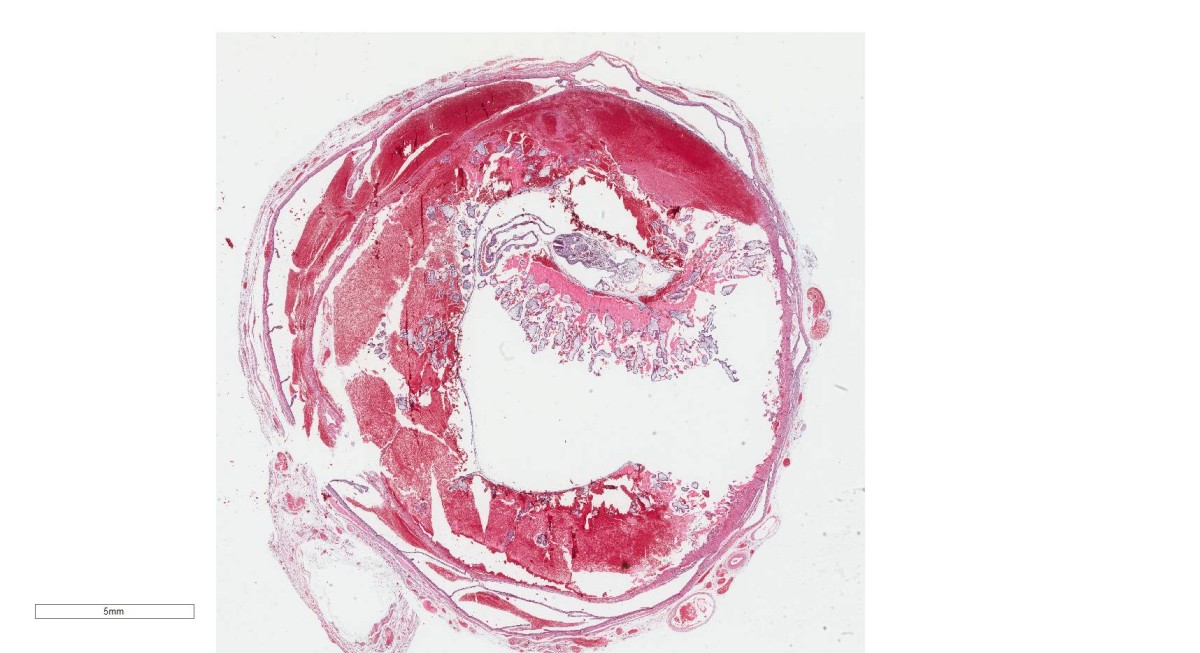
Área localizada de necrose isquêmica em um órgão ou tecido resultante da oclusão de seu suprimento arterial ou de sua drenagem venosa.
Causas
99% resultam de fenômenos tromboembólicos, Raramente:Enfermidades vasculares, compressão vascular por tumores ou aderências fibrosas, torção do pedículo de vísceras móveis, vasoespasmo, aprisionamento em sacos herniais
Classificação
Quanto a cor: Branco ou Anêmico, Vermelho ou Hemorrágico.
Quanto a concomitância com infecções: Séptico e Asséptico
- Enfartes Brancos e Anêmicos: Ocorrem em oclusão arterial com via única e terminal, tecidos sólidos, sem reperfusão.
São exemplos de tecidos com este padrão: coração, rim e baço
- Enfartes Vermelhos ou hemorrágicos: Oclusão venosa, Tecidos frouxos, Tecidos com circulação dupla, Tecidos previamente congestos.
São exemplos de tecidos com este padrão: Pulmão, Ovário e testículo, Intestino delgado, Cérebro
Morfologia
Tem forma de cunha com o ápice apontado para o local de oclusão vascular
A alteração citológica característica é de necrose coagulativa com exceção do cérebro (liquefação) e os sépticos (abscessos)
Segue uma resposta inflamatória e reparadora com cicatriz tecidual.
Alterações no processo de proliferação e diferenciação celular resultam em distúrbios. As lesões resultantes são numerosas e podem ser agrupadas em:
Alterações do volume celular (Hipertrofia e Hipotrofia)
Alterações do número de células (Hiperplasia e Hipoplasia)
Alterações da diferenciação celular (Metaplasia)
Alterações da proliferação e da diferenciação celulares (Displasia e Neoplasia)
Outros distúrbios (Agenesia, Distrofia, Ectopia ou heterotopia, Hamartia, Coristia)
BRASILEIRO FILHO, Geraldo. Bogliolo - Patologia. Disponível em: Grupo GEN, (10th edição). Grupo GEN, 2021.
ATROFIA - É A REDUÇÃO DO TAMANHO DE UM ÓRGÃO OU TECIDO CAUSADA PELA REDUÇÃO DO NÚMERO E TAMANHO DAS CÉLULAS.
Conceito: Processo adaptativo reversível onde as células diminuem de tamanho por perda de substância celular ou de seus constituintes celulares. Associado à alterações no equilíbrio entre síntese e degradação de proteínas. Quando um número suficiente de células é envolvido o órgão ou tecido diminuem de tamanho.
Mecanismo: Aumento da degradação de proteínas celulares (em lisossomos ou no sistema ubiquitina-proteassomo) e agressão à proteínas por radicais livres.
Causas: Diminuição de carga/trabalho (atrofia por desuso); Perda de inervação (déficit de inervação); Déficit nutricional; Déficit hormonal; e Déficit de suprimento sanguíneo (comum no envelhecimento)..
Fisiológica (senilidade - cérebro; menopausa - mama, útero; embriologia).
Patológica (inanição, desuso, compressão, obstrução vascular, substâncias tóxicas, hormônios; inervação e inflamação crônica).
HIPERPLASIA- É O AUMENTO DO NÚMERO DE CÉLULAS NUM ÓRGÃO QUE RESULTA DO AUMENTO DA PROLIFERAÇÃO, SEJA DE CÉLULAS DIFERENCIADAS COMO EM ALGUNS CASOS DE CÉLULAS PROGENITORAS.
Conceito: Processo adaptativo reversível onde ocorre aumento no número de células em um órgão ou tecido. Envolve divisão celular mitose.
Mecanismo: resultado da proliferação de células maduras induzida por fatores de crescimento e, em alguns casos, pela produção aumentada de novas células a partir de células-tronco teciduais. Causas: Estímulos hormonais ou por fatores de crescimento como em neoplasias e infecções virais.
Fisiológica (hiperplasia mamária durante a puberdade; hiperplasia hepática após hepatectomia parcial; hiperplasia da medula óssea após perda ou destruição de elementos do sangue; hiperplasia do útero durante a gravidez). A hiperplasia fisiológica devido à ação de hormônios ou de fatores de crescimento ocorre quando há necessidade de aumentar a capacidade funcional de órgãos sensíveis a hormônios, ou quando há necessidade de um aumento compensatório após dano ou ressecção.
Patológica (hiperplasia prostática benigna; hiperplasia endometrial). As formas de hiperplasia patológica são causadas, em sua maioria, pelas ações excessivas ou inapropriadas de hormônios ou de fatores de crescimento que atuam sobre as células-alvo. A hiperplasia constitui uma resposta característica a certas infecções virais, como os papilomavírus, que causam verrugas cutâneas e várias lesões da mucosa compostas por massas de epitélio hiperplásico.
Kumar, Vinay, et al. Robbins & Cotran Patologia: Bases Patológicas das Doenças. Disponível em: Grupo GEN, (10th edição). Grupo GEN, 2023.
O que é: Método PAS ( Ácido Períodico + Reativo de Schiff ); do Mucicarmin de Mayer é uma das colorações para demonstrar componentes de tecido normal e patológico caracterizados por conter grupos glicólicos ou aminohidroxílicos como por exemplo; fungos e membrana basal. Este método é primariamente usado para identificar glicogênio em tecidos. A reação do ácido oxida com glicóis vicinais, como encontrados na glicose, produzindo aldeídos, que reagindo com o reagente de Schiff produz uma substância de cor púrpura-magenta.
Uso: Sua indicação inclui estruturas com alta proporção de macromoléculas de carboidratos ( glicogênio, glicoproteínas neutras) encontradas no tecido conjuntivo, mucosubstância produzidas pelas células caliciformes e na identificação da membrana basal. Também é utilizada para distinguir entre diferentes tipos de doença de depósitos de glicogênio, identificação da célula de Paget, ou na doença de Whipple, e de micoses ( a positividade decorre da composição química, rica em açúcares complexos, tanto na parede celular quanto na cápsula de alguns fungos ).¹²
Composição da parede celular dos fungos
A camada eletrodensa que circunda a célula fúngica é composta por diversos tipos de açúcares, incluindo quitina, beta 1,3 glucan, beta1,6 glucane e manoproteinas. A quitina participa da parede celular de fungos, do exoesqueleto de artrópodes como crustáceos e insetos. Em termos de estrutura,, a quitina pode ser comparada à celulose, em termos de função, à proteína de queratina. Na parede celular de fungos, a quitina é encontrada na camada mais próxima à membrana plasmática, portanto mais interna. Betas glucans são polissacarídeos que contém apenas glicose como componente estrutural, sendo unidas por ligações beta glicosídicas. Correspondem a maior parte da parede celular dos fungos, estando situados na parte média da mesma. E as manoproteínas são proteínas altamente glicosiladas pelos monossacarídeo manose. Ocorrem na parte mais externa da parede celular ou, segundo outras fontes, tambeém na face interna, junto com a quitina. E assim como todos os componentes químicos da parede celular são açúcares, compreende-se a forte positividade pelo PAS.
Resultado:
Glicogênio, mucina, membrana basal, fungos- púrpura-magenta.
Núcleos em azul.
Referências:
1. Vitorino Modesto dos Santos, et al; Contribuição ao diagnóstico morfológico da adiaspiromicose pulmonar; Revista da Sociedade Brasileira de Medicina Tropical; doi: 10.1590/S0037-86822000000500012 - www.scielo.br
2. Rosicler Rocha, Antonio de Souza Marques, Tania Ludmila de Assis; Aspecto da derme em casos de dermatofitose(dados preliminares); Anais Brasileiro de Dermatologia; vol 48-num 4: Artigos originais - www.anaisdedermatologia.org.br
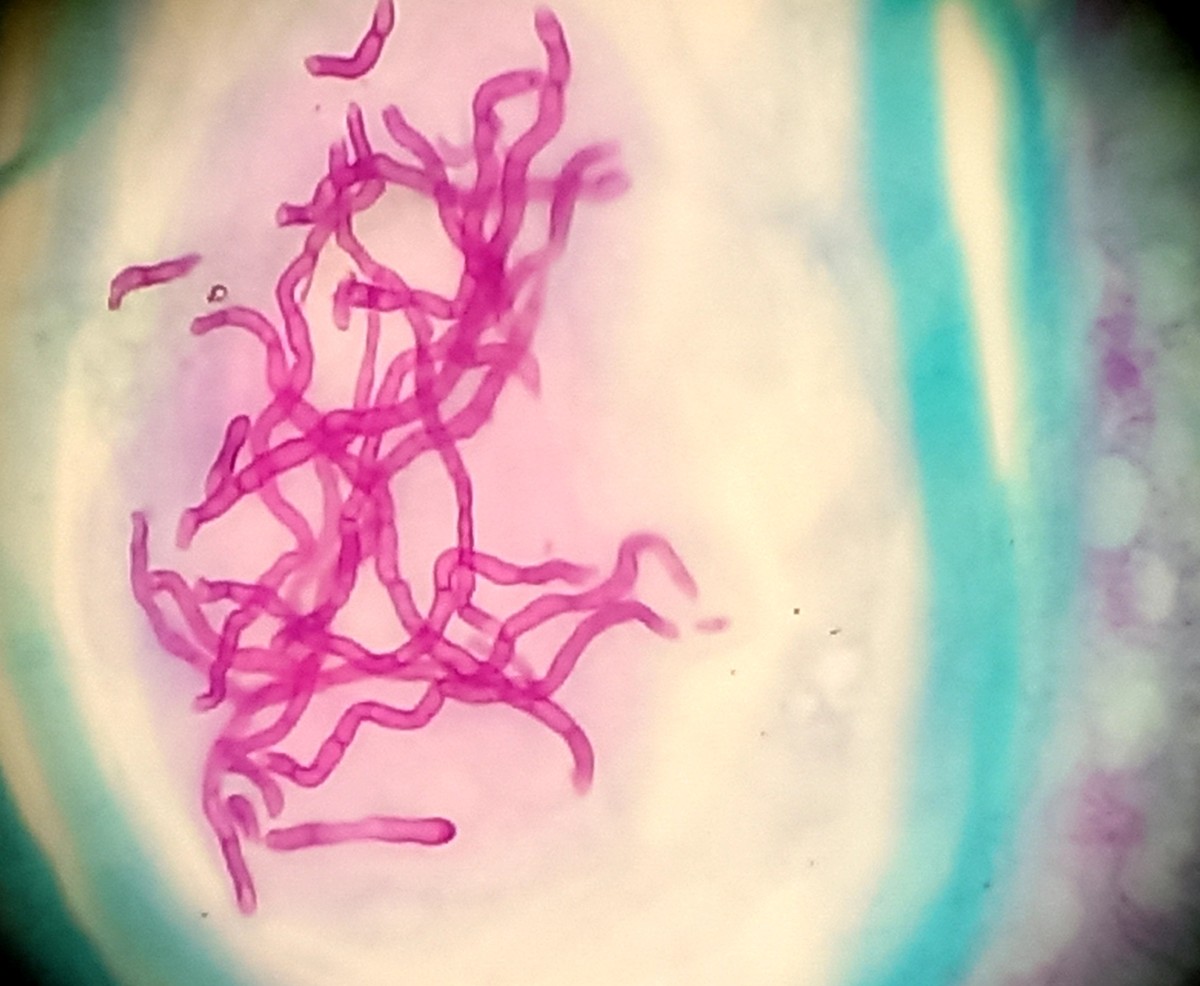
Giemsa é uma coloração em homenagem ao químico alemão e bacteriologista Gustav Giemsa. É usado em citogenética para o diagnóstico histopatológico de parasitas como malária, trofozoítos (T. vaginalis), algumas outras espiroquetas, protozoários parasitas no sangue como a leishmania. É um corante de esfregaço do sangue periférico, medula óssea ou estudo citológico de elementos celulares colhidos por punção, raspagem ou concentrados celulares de derrames cavitários. Indicado para visualizar cromossomos (ela é específica para os grupos fosfato de DNA e se adere a regiões do DNA que tenham grande quantidade de ligações timina-adenina), bactéria Clamídia, H. pylori e grãos mastocitários. É usado para tingir cromossomos, e criar um cariograma, e identificar aberrações cromossômicas como translocações e rearranjos.
Produção e técnica de uso
A coloração de Giemsa é um membro do grupo de colorações de Romanowski. É uma mistura de azul de metileno, eosina e azure B. O corante geralmente é preparado a partir de pó de corante Giemsa comercialmente disponível no mercado.
Referências Bibliográficas
1.Giemsa´s Staining Protocol for Tissues Sections – www.ihcworld.com
2. Giemsa Staining- biomedical-sciences. Uq.edu.au
3. Perea Sasiaín J; Giemsa stain’ 100th year. Biomedica 2003 Mar, 23 (1): 5-18.
4. Michalany.J Técnica Histológica em Anatomia Patológica: com instruções para cirurgião, enfermeira e citotécnico. São Paulo; Michalany, Terceira Edição; 1998, 295p. ilus,tab
.jpeg)
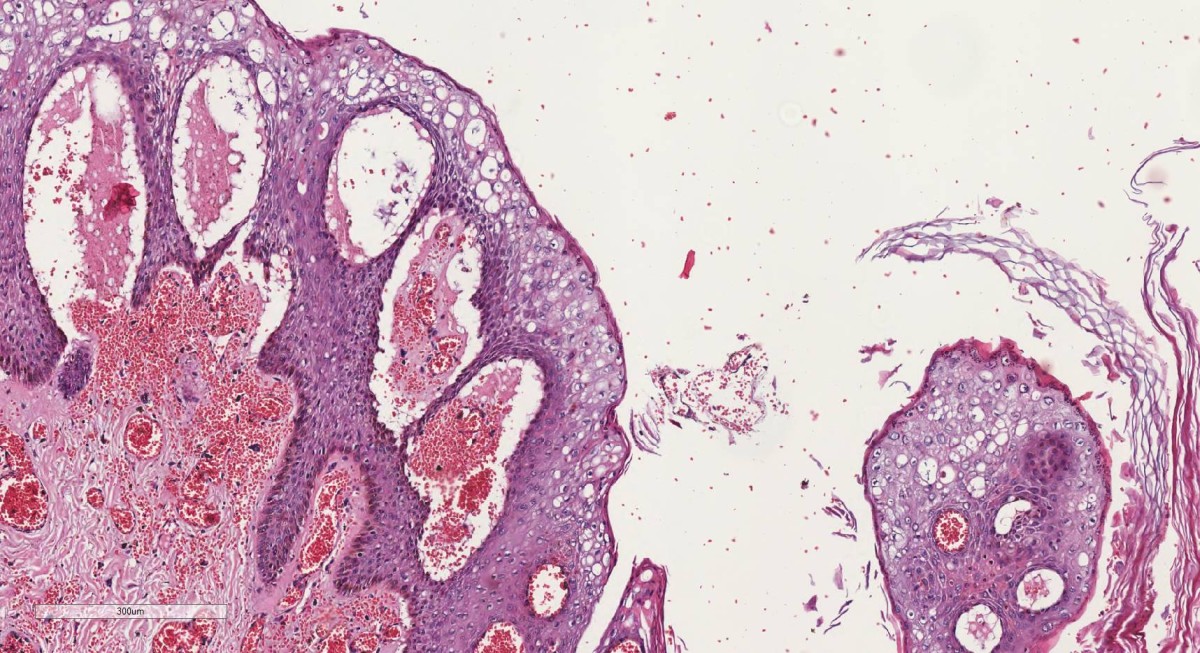
Neoplasias Malignas - podem invadir e destruir estruturas adjacentes e disseminar-se para áreas distantes (metastatizar). Costumam ser referidos coletivamente como cânceres, termo derivado da palavra latina caranguejo.
Propriedades e as características fenotípicas das células malignas:
(a) autonomia de proliferação;
(b) insensibilidade aos sinais inibidores de mitose;
(c) imortalidade;
(d) instabilidade genômica;
(e) capacidade de induzir angiogênese;
(f) adaptações metabólicas;
(g) capacidade de invadir e dar metástases;
(h) indução de resposta inflamatória;
(i) evasão do sistema imunitário;
(j) alterações em funções celulares.
Os tumores malignos que surgem em tecidos mesenquimais sólidos costumam ser denominados sarcomas (do grego sar = carnoso; por exemplo, fibrossarcoma e condrossarcoma), enquanto os que se originam de células formadoras do sangue são designados como leucemias (literalmente, sangue branco) ou linfomas (tumores de linfócitos ou seus precursores). As neoplasias malignas que se originam de células epiteliais são denominadas carcinomas.
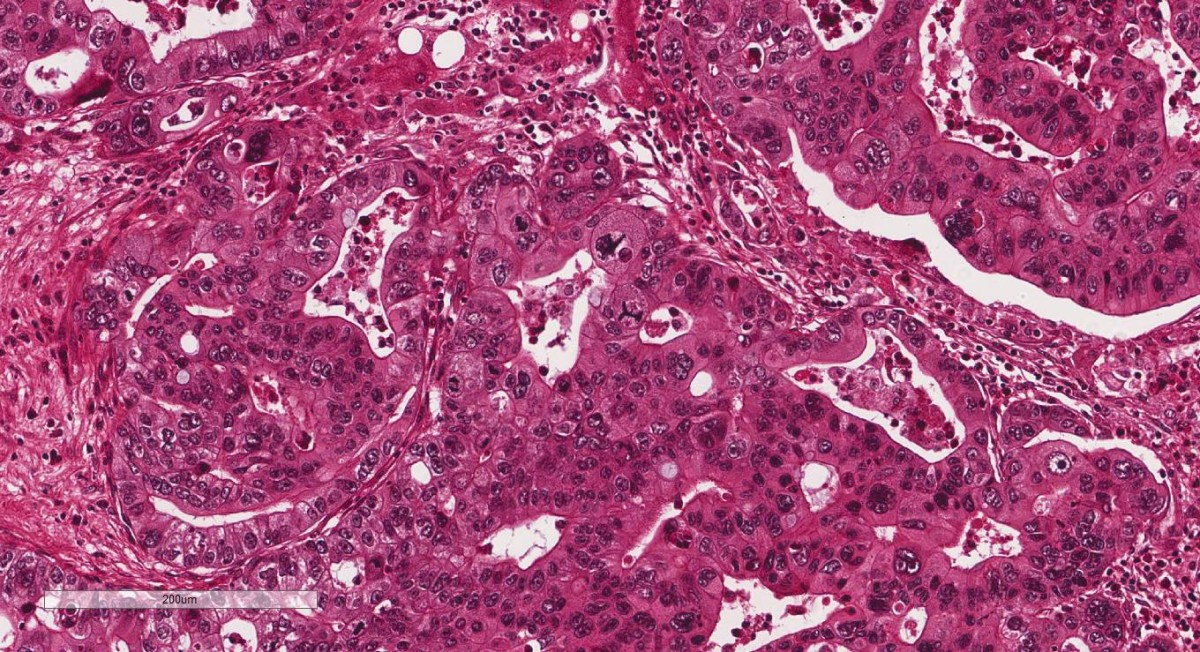
Características gerais: proliferação celular descontrolada; células geralmente pouco diferenciadas com atipias celulares e arquiteturais evidentes e com alto índice mitótico o que reflete o seu crescimento rápido. Os tumores são geralmente infiltrativos, ulcerados.
As células neoplásicas se multiplicam rápido, o mesmo não acontece com o estroma e os vasos sanguíneos, que se desenvolvem mais lentamente, resultando em áreas de degeneração, necrose, hemorragia e ulceração.
Aspectos macroscópicos: císticos ou sólidos, mal delimitados, infiltrativos, presença de úlcera.
Aspectos microscópicos: Células neoplásicas exibindo atipias variadas, entre elas aumento da relação núcleo/citoplasma; cromatina irregular e mais compacta (hipercromasia nuclear), podendo haver células bi ou multinucleadas; figuras de mitose atípicas (mitoses tri ou multipolares); hipercelularidade; pleomorfismo celular (citoplasma mostra variações no volume e na forma das células), angiogênese, infiltração ou invasão perivascular/perineural, células inflamatórias.
Atipia acentuada e perda das características morfológicas caracterizam a anaplasia. O tumor perde a diferenciação e fica difícil de ser reconhecido do ponto de vista morfológico.
Kumar, Vinay, et al. Robbins & Cotran Patologia: Bases Patológicas das Doenças. Disponível em: Grupo GEN, (10th edição). Grupo GEN, 2023.
BRASILEIRO FILHO, Geraldo. Bogliolo - Patologia. Disponível em: Grupo GEN, (10th edição). Grupo GEN, 2021.
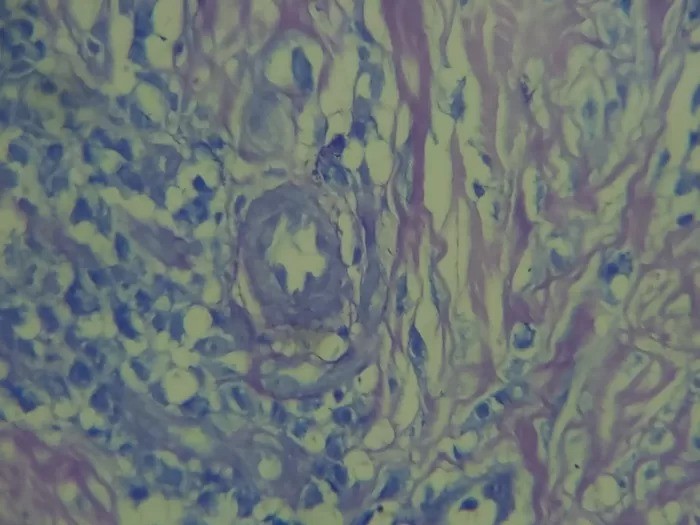
METAPLASIA - Mudança no fenótipo das células diferenciadas, geralmente em resposta à irritação crônica, tornando as células mais capazes de resistir ao estresse; geralmente induzida por uma alteração na via de diferenciação das células-tronco do tecido; pode resultar em diminuição das funções ou aumento da propensão à transformação maligna.
Conceito: Processo adaptativo reversível, em que um tipo celular diferenciado (epitelial ou mesenquimal) é substituído por outro tipo celular.
Mecanismo: resultado de uma reprogramação das células-tronco locais do tecido ou, alternativamente, da colonização por populações celulares diferenciadas de áreas adjacentes. Estimulada por sinais gerados por citocinas, fatores de crescimento e componentes da matriz extracelular existentes no ambiente celular.
Causas: tabagismo, esôfago de Barret (decorrente do refluxo de ácido gástrico), deficiência de vitamina A, cálculos em ductos e vias biliares, glândulas salivares.
Conceito: Consiste na deposição de sais de cálcio em locais normalmente não calcificados. É uma lesão muito frequente, embora geralmente não traga consequências graves.
Podem ser subdivididas em:
(1) distrófica, quando predominam fatores locais, como necrose;
(2) metastática, em casos de hipercalcemia;
(3) idiopáticas, em que nenhum desses fatores está presente.
Morfologicamente, é reconhecida por sua basofilia (forte coloração pela hematoxilina).
Kumar, Vinay, et al. Robbins & Cotran Patologia: Bases Patológicas das Doenças. Disponível em: Grupo GEN, (10th edição). Grupo GEN, 2023.
BRASILEIRO FILHO, Geraldo. Bogliolo - Patologia. Disponível em: Grupo GEN, (10th edição). Grupo GEN, 2021.
HIPERTROFIA - É O AUMENTO DO TAMANHO DE UM ÓRGÃO CAUSADO PELO AUMENTO DO TAMANHO DAS CÉLULAS.
Conceito: Processo adaptativo reversível onde as células aumentam de tamanho por síntese de quantidade maior de componentes estruturais da célula (maior síntese proteica).
Mecanismo: Ações conjuntas dos sensores mecânicos, fatores de crescimento e agentes vasoativos: fatores de crescimento; ativação de vias de transdução de sinal intracelulares; fatores de transcrição promovem a maior síntese de proteínas.
Causas: Estímulos hormonais; aumento de demanda funcional
Fisiológica (musculatura uterina na gravidez; mamas na puberdade e lactação)
Patológica (músculos dos atletas e trabalhadores braçais; hipertrofia do miocárdio (Doenças cardiovasculares). macrófagos na atividade fagocitária.
Apoptose: A apoptose é um programa de morte celular extremamente regulado e de grande eficiência, que requer a interação de inúmeros fatores. As alterações morfológicas observadas são consequência de uma cascata de eventos moleculares e bioquímicos específicos e geneticamente regulados. Um número crescente de genes tem sido identificado como capazes de influenciar o processo de apoptose. Entre eles destaca-se a família das proteínas Bcl-2, que desempenha papel crítico na regulação da apoptose em condições fisiológicas ou patológicas. Algumas dessas proteínas, como Bcl-2 e Bcl-XL, Bcl-w, Mcl-1 e A1 são antiapoptóticas, enquanto outras, tais como a Bax, Bad e Bid são pró-apoptóticas. É uma via de morte celular induzida por um programa de suicídio fortemente regulado onde as células destinadas à morte ativam enzimas intrínsecas que degradam seu próprio DNA nuclear, proteínas nucleares e citoplasmáticas. Pode também ser considerada uma via de morte celular isolada onde ocorre declínio progressivo da função e viabilidade celular causados por anormalidades genéticas e acúmulos de danos moleculares e celulares devido aos efeitos da exposição a influências exógenas.
Alterações morfológicas na apoptose: encolhimento celular (citoplasma denso e organelas agrupadas), condensação da cromatina (massas densas na periferia da membrana nuclear), formação de ‘bolhas’ citoplasmáticas (corpos apoptóticos: fragmentos compostos por citoplasma, organelas, com ou sem fragmentos nucleares) e fagocitose das células (apoptóticas ou dos corpos apoptóticos) por macrófagos.
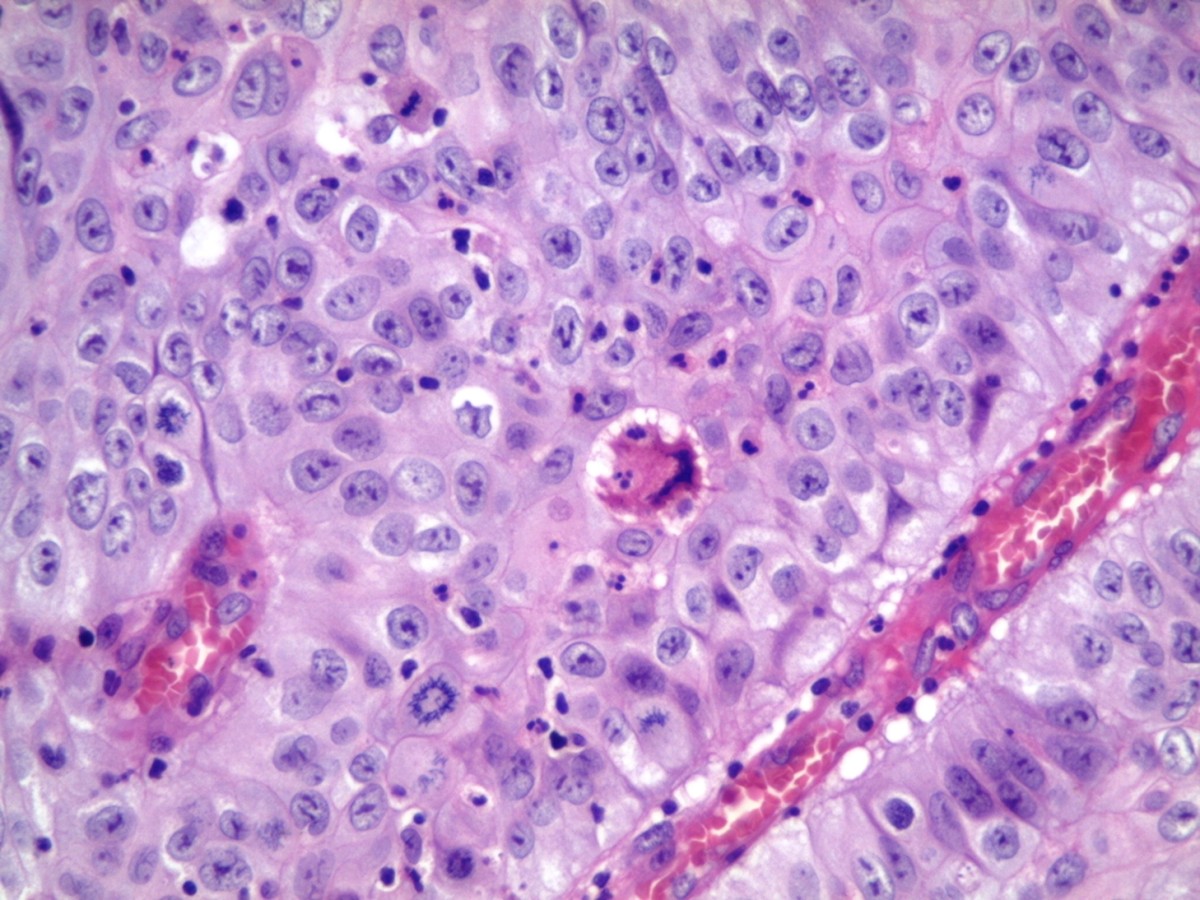
As células morrem por diferentes mecanismos, dependendo da natureza e da gravidade da lesão. Distúrbios graves, com perda de oxigenação e fornecimento de nutrientes, e ação de toxinas, causam uma rápida e não controlada morte da célula, denominada de morte acidental. A manifestação morfológica desse tipo de morte acidental é a necrose.
Necrose: ocorre desintegração de membranas celulares, liberação do conteúdo enzimático e digestão celular, que é acompanhada por reação inflamatória. A perda da integridade da membrana lisossomal resulta em digestão enzimática da célula e progressão para a necrose. As alterações morfológicas são visualizadas no citoplasma e núcleo das células lesadas.
Alterações citoplasmáticas: aumento da eosinofilia devido ao aumento da ligação da eosina às proteínas desnaturadas e a perda do ácido ribonucleico nuclear (RNA). Células necróticas apresentam um citoplasma com aspecto vítreo, homogêneo, comumente devido à perda de glicogênio.
Alterações nucleares: picnose que é caracterizada pelo encolhimento nuclear e aumento da basofilia (condensação do DNA em uma “massa” escura e encolhida). O núcleo picnótico pode sofrer fragmentação, fenômeno conhecido como cariorrexe. Ao mesmo tempo, o núcleo pode sofrer cariólise, em que a basofilia desaparece devido à digestão do DNA pela DNase. Em 2 e 3 dias, o núcleo pode sofrer dissolução completa.
As células necróticas podem persistir por muito tempo ou serem digeridas por enzimas e desaparecer. As células mortas podem ser substituídas por figuras de mielina, que são fagocitadas ou degradadas em ácidos graxos. Esses ácidos graxos ligam-se a sais de cálcio, o que pode fazer com que as células mortas tornem-se calcificadas (processo conhecido como calcificação distrófica).
KUMAR, V; ABBAS; A.K.; ASTER, J.C.; ROBBINS, A.T.K. Basic Pathology, Eleventh Edition. Philadelphia. Elsevier. 2022.

.jpeg)
Lesão celular irreversível: embora não haja mudanças morfológicas e bioquímicas específicas nesse tipo de lesão, ela é consistentemente caracterizada por três fenômenos:
(1) incapacidade de restaurar a função mitocondrial (fosforilação oxidativa e geração de ATP);
(2) alteração estrutural e perda da integridade da membrana plasmática e membranas intracelulares;
(3) perda estrutural da integridade do ácido desoxirribonucleico (DNA) e cromatina.
KUMAR, V; ABBAS; A.K.; ASTER, J.C.; ROBBINS, A.T.K. Basic Pathology, Eleventh Edition. Philadelphia. Elsevier. 2022.
.jpeg)
.jpeg)